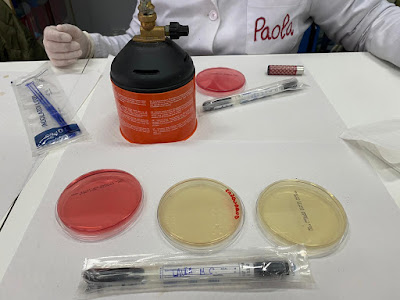
PRACTICA 21: SIEMBRA EN ANAEROBIOSIS

18.02.20 OBJETIVO. Observar el crecimiento de microorganismos en anaerobiosis MATERIAL. Placa petri con agar sangre. Hisopo. Mechero bunsen. Jarra de anaerobiosis. Estufa. Microscopio. GENbox anaer. PROCEDIMIENTO. Pasamos un hisopo por la boca para recoger el microorganismo. Sembramos la placa con agar sangre por agotamiento de estrías. Ponemos la placa en la jarra de anaerobiosis y colocamos un sobre abierto de GENbox anaer. De esta forma creamos una atmósfera anaerobia en la que sólo crecerán este tipo de microorganismos (anaerobios) Ponemos en la estufa e incubamos a 37ºC durante 24 horas. Tras este periodo de tiempo observamos el crecimiento de anaerobios en el microscopio. Pero primeramente realizamos una tinción de Gram El resultado fue que nos encontramos con bacilos Gram negativos