PRÁCTICA 12: PRUEBAS BIOQUÍMICAS PARA BACILOS GRAM NEGATIVOS
10.01.2020
OBJETIVO
Identificar que tipo de bacilo gram negativo es el que hay presente en una muestra basándonos en pruebas de identificación bioquímica.
FUNDAMENTO
Dada la gran variedad de especies, hay microorganismos que crecen en medios no enriquecidos y en propios para enterobacterias, otros que se asilan usando medios especiales y otros nutricionalmente exigentes. Prueba tras prueba vamos a ir descartando que microorganismo es hasta dar con el microorganismo correcto.
NOTA: Todos los medios de cultivo venían ya preparados por lo que no fue necesario elaborarlos en clase.
PROCEDIMIENTO
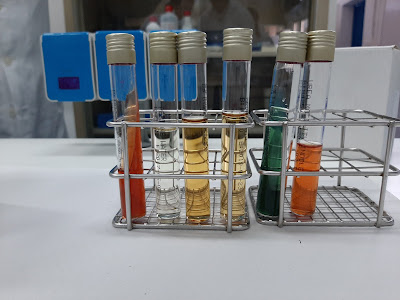
Antes que nada preparamos todos los medios ya preparados sobre una gradilla y lo pusimos en orden de realización para evitar confusiones, siendo primero el Kligler, Indol, Rojo de metilo, VP, citrato y urea.
KLIGLER
Realizamos diferentes pruebas, primero empezamos con la Kligler, para así identificar a la familia de las enterobacterias. El medio de Agar hierro de KLIGLER es un medio sólido diferencial que se prepara en slant y contiene lactosa, glucosa, peptona y un indicador de pH (rojo fenol) que vira a amarillo cuando el pH es ácido y toma color rojo cereza cuando el pH es alcalino. Este medio permite distinguir si el microorganismo usa glucosa, glucosa y lactosa o ninguno; además de la producción de gas y de ácido sulfhídrico.
Para realizar esta prueba se tomó una colonia y se sembró con hilo de platino en picadura primero en el fondo del tubo y a continuaci´n se sembró en estría sobre la superficie.
Lectura de resultados: vimos que viró a un color ligeramente rojizo tanto en la superficie del slant como en el fondo del tubo pero no había gases ni la presencia de ácido sulfhídrico por lo que es +/-/+/-.
OBSERVACIONES
No se apreció un color característico rojo cereza ya que posteriormente se descubrió que dicho cultivo no era puro por lo que los otros microorganismos crearían interferencias en el medio.
IMVIC
Es un conjunto de cuatro pruebas bioquímicas para la identificación bacteriana que consta del Indol, Rojo de metilo, Voges-Proskauer y Citrato
Indol
Se usa para identificar bacterias que producen la enzima triptonasa para degradar el triptófano en indol, la presencia de indol se visualiza con el reactivo de Kovacs.
Se realiza inoculando una colonia en el tubo con nuestro medio de cultivo ya preparado y se incuba a 37ºC de 24 a 48 horas.
Tras la incubación se añadió el reactivo de kovacs y se esperó dos minutos. No apareció ningún circulo rojo por lo que es negativo.
Rojo de Metilo y VP
Se usan para identificar a las enterobacterias que pueden metabolizar la glucosa en 2 fases: por metabolismo aerobio y anaerobio, el cual puede ser de dos tipos:
Tras la incubación se añadió rojo de metilo y vp respectivamente y se esperó 15 minutos y no se apreció ningún cambio por lo que es negativo.
Citrato
Se usa para identificar a las Enterobacterias
En esta prueba se determina la presencia de la enzima citrasa que tienen algunos microorganismos para usar el citrato como unica fuente de carbono, dando lugar a productos alcalinos.
El citrato se produce en el ciclo de krebs, pero algunos organismos son capacees de usarlo como unica fuente de carbono cuando no hay mas carbohidratos fermentables en el medio.
Se inocula la muestra con el asa en la superficie inclinada del medio citrato de Simmons y se incuba a 37 ºC
Tras la incubacuin no observamos ningún cambio por lo que es negativo
TEST DE LA UREA
Se utiliza para diferenciar a los microorganismos capaces de hidrolizar la urea por la acción del enzima ureasa, esta enzima al hidrolizar la urea origina amoniaco el cual produce un aumento del pH del medio y puede detectarse mediante rojo fenol.
Para ello inoculamos las bacterias en el medio caldo urea indol y se incuba a 37ºC
Vimos que no viró a color rosa por lo que es negativo.
REDUCCIÓN DE NITRATOS
Algunas bacterias anaerobias o anaerobias facultativas pueden reducir los nitratos a nitritos por acción del enzima nitrato reductasa o puede ser reducido hasta gases u otros productos. Las enterobacterias y pseudomonas son normalmente positivos.
Para realizar esta prueba si realizamos el medio nosotros porque no lo teníamos, para ello siguiendo las instrucciones del fabricante, pesamos 9 gramos de nitrato y lo mezclamos con 100 mL de agua destilada.
Seguidamente lo esterilizamos en autoclave
OXIDASA
Esta prueba sirve para determinar la presencia de enzimas oxidasas
Para ello usamos un portaobjetos sobre el que dispusimos un trozo de papel de filtro, y dispensamos una colonia en el centro con el asa de siembra y seguidamente se añadió el reactivo de Kovacs, vimos que era negativo; pero para ver como saldría una prueba positiva usamos Pseudomonas que sabemos que da positivo esta prueba para ver que saldría. Tras realizar el mismo proceso pero con este microorganismo observamos que dio positivo porque apareció una mancha violeta oscuro,
SISTEMAS COMERCIALES DE IDENTIFICACIÓN
Sistema en tiras :API 20E
Los sistemas en tiras son tiras con cúpulas de plástico que contienen el sustrato deshidratado y que se regeneran con una suspensión del microorganismo problema.
Aunque hay mas sistemas en tiras nosotros usamos este, el cual permite la diferenciacion de Enterobacterias y otros bacilos gram - no exigentes como Serratia, Shigella y Yersinia.
Encendemos el mechero bunsen y trabajamos dentro de su área.
Para realizar esto usamos un bote de 5 mL de SSF y ahí inoculamos una colonia de nuestro microorganismo problema.
Llenamos de agua la camara de incubación.
Una vez realizado esto, con pipetas pasteur esteriles rellenamos los tubos con la suspensión, todos se llenan solo el tubo excepto los que vienen enmarados por 3 lados en los que se llena también la cúpula, luego se sella con parafina los que están enmarcados solo por una línea. Seguidamente metemos el API en la cámara de incubación y lo metemos en la estufa.
Tras la incubación procedimos a la lectura de resultados, pero primero comprobamos que 3 fueron correctos, tras ello depositamos una gota de FeCl3 en el TDA, luego en el VP añadimos VP1 y VP2 y por ultimo realizamos lo mismo con el reactivo de James en el de indol(es muy importante realizar este el ultimo debido a formación de gases que podrían alterar otras pruebas).
Los resultados fueron los siguientes:
Con estos datos obtuvimos el siguiente código, que mirando en la base de datos vemos que corresponde con una Kliebsella.
OBJETIVO
Identificar que tipo de bacilo gram negativo es el que hay presente en una muestra basándonos en pruebas de identificación bioquímica.
FUNDAMENTO
Dada la gran variedad de especies, hay microorganismos que crecen en medios no enriquecidos y en propios para enterobacterias, otros que se asilan usando medios especiales y otros nutricionalmente exigentes. Prueba tras prueba vamos a ir descartando que microorganismo es hasta dar con el microorganismo correcto.
Material necesario
- Mechero bunsen
- Portaobjetos
- Papel de filtro
- Asa de siembra.
- Hilo de platino
- Gradillas
- Estufa
NOTA: Todos los medios de cultivo venían ya preparados por lo que no fue necesario elaborarlos en clase.
PROCEDIMIENTO
Antes que nada preparamos todos los medios ya preparados sobre una gradilla y lo pusimos en orden de realización para evitar confusiones, siendo primero el Kligler, Indol, Rojo de metilo, VP, citrato y urea.
KLIGLER
Realizamos diferentes pruebas, primero empezamos con la Kligler, para así identificar a la familia de las enterobacterias. El medio de Agar hierro de KLIGLER es un medio sólido diferencial que se prepara en slant y contiene lactosa, glucosa, peptona y un indicador de pH (rojo fenol) que vira a amarillo cuando el pH es ácido y toma color rojo cereza cuando el pH es alcalino. Este medio permite distinguir si el microorganismo usa glucosa, glucosa y lactosa o ninguno; además de la producción de gas y de ácido sulfhídrico.
Para realizar esta prueba se tomó una colonia y se sembró con hilo de platino en picadura primero en el fondo del tubo y a continuaci´n se sembró en estría sobre la superficie.
Lectura de resultados: vimos que viró a un color ligeramente rojizo tanto en la superficie del slant como en el fondo del tubo pero no había gases ni la presencia de ácido sulfhídrico por lo que es +/-/+/-.
OBSERVACIONES
No se apreció un color característico rojo cereza ya que posteriormente se descubrió que dicho cultivo no era puro por lo que los otros microorganismos crearían interferencias en el medio.
Es un conjunto de cuatro pruebas bioquímicas para la identificación bacteriana que consta del Indol, Rojo de metilo, Voges-Proskauer y Citrato
Indol
Se usa para identificar bacterias que producen la enzima triptonasa para degradar el triptófano en indol, la presencia de indol se visualiza con el reactivo de Kovacs.
Se realiza inoculando una colonia en el tubo con nuestro medio de cultivo ya preparado y se incuba a 37ºC de 24 a 48 horas.
Tras la incubación se añadió el reactivo de kovacs y se esperó dos minutos. No apareció ningún circulo rojo por lo que es negativo.
Rojo de Metilo y VP
Se usan para identificar a las enterobacterias que pueden metabolizar la glucosa en 2 fases: por metabolismo aerobio y anaerobio, el cual puede ser de dos tipos:
- La fermentación ácido mixta en donde los productos finales son ácidos orgánicos y etanol, los cuales generan descenso del pH que se puede detectar con rojo de metilo y da lugar a color rojo. En este caso se realiza el ROJO DE METILO
- La fermentación butilen glicólica donde los productos finales son compuestos neutros como el butanodiol y el etanol, produciéndose acetoína como producto intermediario, que puede ser detectada añadiendo KOH y alfa naftol que reaccionaran produciendo color rojo. En este caso se realiza VOGES PROSKAUER
Tras la incubación se añadió rojo de metilo y vp respectivamente y se esperó 15 minutos y no se apreció ningún cambio por lo que es negativo.
Citrato
Se usa para identificar a las Enterobacterias
En esta prueba se determina la presencia de la enzima citrasa que tienen algunos microorganismos para usar el citrato como unica fuente de carbono, dando lugar a productos alcalinos.
El citrato se produce en el ciclo de krebs, pero algunos organismos son capacees de usarlo como unica fuente de carbono cuando no hay mas carbohidratos fermentables en el medio.
Se inocula la muestra con el asa en la superficie inclinada del medio citrato de Simmons y se incuba a 37 ºC
Tras la incubacuin no observamos ningún cambio por lo que es negativo
TEST DE LA UREA
Se utiliza para diferenciar a los microorganismos capaces de hidrolizar la urea por la acción del enzima ureasa, esta enzima al hidrolizar la urea origina amoniaco el cual produce un aumento del pH del medio y puede detectarse mediante rojo fenol.
Para ello inoculamos las bacterias en el medio caldo urea indol y se incuba a 37ºC
Vimos que no viró a color rosa por lo que es negativo.
REDUCCIÓN DE NITRATOS
Algunas bacterias anaerobias o anaerobias facultativas pueden reducir los nitratos a nitritos por acción del enzima nitrato reductasa o puede ser reducido hasta gases u otros productos. Las enterobacterias y pseudomonas son normalmente positivos.
Para realizar esta prueba si realizamos el medio nosotros porque no lo teníamos, para ello siguiendo las instrucciones del fabricante, pesamos 9 gramos de nitrato y lo mezclamos con 100 mL de agua destilada.
Seguidamente lo esterilizamos en autoclave
OXIDASA
Esta prueba sirve para determinar la presencia de enzimas oxidasas
Para ello usamos un portaobjetos sobre el que dispusimos un trozo de papel de filtro, y dispensamos una colonia en el centro con el asa de siembra y seguidamente se añadió el reactivo de Kovacs, vimos que era negativo; pero para ver como saldría una prueba positiva usamos Pseudomonas que sabemos que da positivo esta prueba para ver que saldría. Tras realizar el mismo proceso pero con este microorganismo observamos que dio positivo porque apareció una mancha violeta oscuro,
SISTEMAS COMERCIALES DE IDENTIFICACIÓN
Sistema en tiras :API 20E
Los sistemas en tiras son tiras con cúpulas de plástico que contienen el sustrato deshidratado y que se regeneran con una suspensión del microorganismo problema.
Aunque hay mas sistemas en tiras nosotros usamos este, el cual permite la diferenciacion de Enterobacterias y otros bacilos gram - no exigentes como Serratia, Shigella y Yersinia.
Encendemos el mechero bunsen y trabajamos dentro de su área.
Para realizar esto usamos un bote de 5 mL de SSF y ahí inoculamos una colonia de nuestro microorganismo problema.
Llenamos de agua la camara de incubación.
Una vez realizado esto, con pipetas pasteur esteriles rellenamos los tubos con la suspensión, todos se llenan solo el tubo excepto los que vienen enmarados por 3 lados en los que se llena también la cúpula, luego se sella con parafina los que están enmarcados solo por una línea. Seguidamente metemos el API en la cámara de incubación y lo metemos en la estufa.
Tras la incubación procedimos a la lectura de resultados, pero primero comprobamos que 3 fueron correctos, tras ello depositamos una gota de FeCl3 en el TDA, luego en el VP añadimos VP1 y VP2 y por ultimo realizamos lo mismo con el reactivo de James en el de indol(es muy importante realizar este el ultimo debido a formación de gases que podrían alterar otras pruebas).
Los resultados fueron los siguientes:
Con estos datos obtuvimos el siguiente código, que mirando en la base de datos vemos que corresponde con una Kliebsella.


































Comentarios
Publicar un comentario